| |
| Med Sci (Paris). 2009 June; 25(6-7): 565–566. Published online 2009 June 15. doi: 10.1051/medsci/2009256-7565.La protéine kinase activée par l’AMP (AMPK)
protège les réserves énergétiques Patrick Narbonne* and Richard Roy* Université McGill, département de biologie, 1205, avenue du Docteur Penfield, Montréal (Québec) H3A 1B1, Canada MeSH keywords: AMP-Activated Protein Kinases, Adipocytes, Catécholamines, Métabolisme énergétique, Humains, Muscles squelettiques, Triglycéride |
Les fluctuations environnementales se traduisent souvent par de longues périodes pendant lesquelles les ressources se font rares. La plupart des organismes résistent toutefois à ces tribulations en stimulant la constitution de réserves énergétiques. C’est grâce à ces provisions que nous pouvons survivre plusieurs jours sans manger. C’est cette même propriété, couplée à d’autres changements, qui permet à de nombreuses espèces de mammifères, d’insectes et de vers de survivre pendant plusieurs mois en état d’hibernation, de dormance ou de diapause. Les ours, par exemple, accumulent d’énormes réserves de graisse et doublent presque leur poids en prévision de l’hiver durant lequel ils cessent de s’alimenter [
1]. |
Consommation énergétique et disponibilité des triglycérides Dans le règne animal, l’emmagasinage de l’énergie se fait largement sous la forme de triglycérides (TG), lipides qui sont déposés principalement dans les cellules du tissu adipeux, les adipocytes. Un TG est constitué d’une molécule de glycérol à laquelle sont reliées trois longues chaînes de carbone hautement énergétiques appelées acides gras. Pour remettre ces acides gras en circulation, le TG doit être séquentiellement hydrolysé par trois réactions enzymatiques, la première étant catalysée par la lipase des TG adipeux (ATGL) [
2]. Le jeûne, comme l’exercice physique, stimulent la sécrétion de molécules activatrices de la lipolyse, les plus importantes étant les catécholamines [
3]. Celles-ci se lient à des récepteurs sur la membrane des adipocytes, ce qui induit une cascade dont le but ultime est d’activer les lipases des TG, afin de libérer des acides gras et rétablir l’homéostasie énergétique. Lorsque la période de jeûne est prolongée, comme lors de l’hibernation chez les mammifères, divers mécanismes se mettent en place pour réduire la consommation énergétique. Par exemple, des procédés énergivores comme la synthèse de l’ARN et des protéines, ainsi que la division cellulaire, sont globalement réprimés, ce qui permet de réduire au minimum le métabolisme basal de l’organisme [1]. Une fois ces changements établis, nous croyons qu’il n’est probablement plus nécessaire d’activer la lipolyse autant que lors d’un jeûne temporaire, où un niveau d’activité physique et un métabolisme normaux sont maintenus. Cette situation laisse supposer l’existence de mécanismes additionnels qui permettraient de réajuster le niveau de la lipolyse en fonction de la demande énergétique. |
Le rôle protecteur de l’AMP kinase sur les réserves énergétiques Nous avons récemment vérifié l’importance de l’ajustement de l’activité de l’ATGL durant un arrêt prolongé de l’apport alimentaire. Nous avons alors remarqué qu’en l’absence de la protéine kinase activée par l’AMP (AMPK), l’ATGL est hyper-activée lors de la diapause chez un vers nématode (Caenorhabditis elegans), ce qui entraîne un épuisement accéléré de toutes les réserves de graisses du vers. Normalement très endurant à toutes sortes de stress, une fois ses réserves de carburant épuisées, l’animal devient hypersensible à des variations osmotiques, ce qui, à ce stade, réduit son espérance de vie d’environ 75 % [
4]. L’AMPK est une régulatrice clé de l’homéostasie énergétique. En effet, cette protéine kinase, en phosphorylant diverses enzymes, maintient l’équilibre entre la consommation et la production de l’ATP, la source énergétique cellulaire [
5]. Ainsi, lors d’une perturbation énergétique, l’AMPK, tout comme l’ATGL, est activée. L’AMPK peut ainsi, en la phosphorylant directement, modérer l’activité de l’ATGL, de façon à « rationner » l’hydrolyse des TG, pour que cette réserve énergétique dure plus longtemps [4]. Ce procédé peut toutefois sembler quelque peu surprenant, car l’AMPK, considérée comme une enzyme qui est activée en état de crise énergétique pour favoriser la libération de l’énergie emmagasinée et rétablir l’équilibre, devrait théoriquement stimuler la lipolyse [
6]. Cela ne semble cependant pas être le cas. Pour concilier ces observations dans un organisme modèle, il suffit peut-être de raisonner d’un point de vue plus global, en considérant les différents tissus de cet organisme. Ainsi, lors d’un jeûne temporaire ou d’exercices physiques, seules les cellules de certains tissus subissent un stress énergétique. L’AMPK y est activée localement et des catécholamines y sont également sécrétées, véhiculant et stimulant ainsi la lipolyse dans les tissus adipeux. Lorsque la période de jeûne se prolonge, il se peut que la carence énergétique atteigne les tissus adipeux eux-mêmes et y active l’AMPK. Celle-ci y limite alors le drainage de l’énergie emmagasinée en inhibant l’ATGL pour prévenir une consommation trop hâtive des réserves lipidiques de l’organisme (Figure 1). 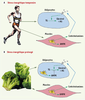 | Figure 1.
Modèle théorique (chez l’humain) expliquant comment l’AMPK pourrait régulariser la lipolyse. A. Joe fait son jogging tous les matins. Durant ces séances, certaines de ses cellules, musculaires par exemple, éprouvent une crise énergétique (CE). Cela y active l’AMPK et y induit aussi la libération de catécholamines. Ces dernières atteignent ses tissus adipeux où elles stimulent la lipolyse et la libération d’acides gras hautement énergétiques. B. Joe suit une diète sévère depuis deux semaines. Pratiquement toutes ses cellules ressentent un stress énergétique. L’AMPK est donc activée aussi dans ses adipocytes, ce qui amoindrit l’effet des catécholamines, rationnant ainsi sa réserve de triglycérides. |
|
Qu’en est-il chez l’homme ? La validité de ces récentes observations demande à être vérifiée chez l’homme, mais certains indices portent à croire que des mécanismes similaires agissent dans des organismes plus complexes que C. elegans. En effet, l’AMPK semble aussi limiter la lipolyse dans les adipocytes de mammifères [6] ; en outre, son activité augmente dans les tissus adipeux lors de l’hibernation chez le souslik à 13 bandes (Spermophilus tridecemlineatus) [
7]. Il a aussi été démontré que dans des cellules humaines HeLa en culture, l’ATGL est phosphorylée à un site qui correspond parfaitement au motif reconnu par l’AMPK [
8]. Il est donc fort probable que ce mécanisme prenne place dans tous les organismes qui pratiquent une forme d’hibernation ou de diapause et, plus généralement, durant une période de stress énergétique prolongée. L’obésité, quant à elle, résulte d’un entreposage excessif de TG dans les tissus adipeux. Le ciblage de la voie de signalisation par l’AMPK dans les tissus adipeux de personnes obèses pourrait donc constituer une approche jusqu’ici insoupçonnée qui permettrait d’accélérer l’élimination des graisses lors d’un régime et, ainsi, représenter un pas vers le traitement de cet état. |
1. Carey HV, Andrews MT, Martin SL. Mammalian hibernation: cellular and molecular responses to depressed metabolism and low temperature. Physiol Rev 2003; 83 : 1153–81. 2. Zimmermann R, Strauss JG, Haemmerle G, et al. Fat mobilization in adipose tissue is promoted by adipose triglyceride lipase. Science 2004; 30 6 : 1383–6. 3. Duncan RE, Ahmadian M, Jaworski K, et al. Regulation of lipolysis in adipocytes. Annu Rev Nutr 2007; 27 : 79–101. 4. Narbonne P, Roy R. Caenorhabditis elegans dauers need LKB1/AMPK to ration lipid reserves and ensure long-term survival. Nature 2009; 457 : 210–4. 5. Hardie DG. AMP-activated/SNF1 protein kinases: conserved guardians of cellular energy. Nat Rev Mol Cell Biol 2007; 8 : 774–85. 6. Daval M, Foufelle F, Ferré P. Functions of AMP-activated protein kinase in adipose tissue. J Physiol 2006; 574 : 55–62. 7. Horman S, Hussain N, Dilworth SM, et al. Evaluation of the role of AMP-activated protein kinase and its downstream targets in mammalian hibernation. Comp Biochem Physiol B Biochem Mol Biol 2005; 142 : 374–82. 8. Bartz R, Zehmer JK, Zhu M, et al. Dynamic activity of lipid droplets: protein phosphorylation and GTP-mediated protein translocation. J Proteome Res 2007; 6 : 3256–65. |


